Energetické zlúčeniny kyseliny aminooctovej a iných aminokyselín
Údaje budú postupne dopĺňané a menené!
(Okrem zlúčenín aminokyselín budú spomenuté aj zlúčeniny obsahujúce príbuzné dusíkaté organické zlúčeniny, napr. kreatín alebo guanidínoctovú kyselinu.)
Zopár energetických zlúčenín kys. aminooctovej (ďalej už len GLY) je už pomerne známych. Ako pomerne výkonné trhaviny sú napríklad použiteľné: komplex GLY s dvomi mólami dusičnanu amónneho - patent US4746380 (s ním súvisí tento papier Effects of amino acids on solid-state phase transition of ammonium nitrate). Soľ kryštalizuje (pri pomalej kryštalizácii) vo forme agregátov z tabulárnych kryštálov, vzdialene podobné napr. barytu:

Alebo dusičnan GLY, ktorý kryštalizuje väčšinou vo forme lístkov, mierne pripomínajúcich sľudu (pri pomalej kryštalizácii) alebo pri rýchlej kryštalizácii tvorí neforemnú kryštalickú masu:


Asi najlepší postup výroby dusičnanu GLY je v tomto čínskom patente (GLY sa priamo pri teplote 25-45°C postupne zmieša so 65% HNO3 v pomere 1-1,1:1 a prepláchne, respektíve dodatočne vyzráža acetónom v pomere GLY:acetón 1g:1ml a roztok sa ochladí na menej ako 10°C). A ešte niečo:

Bolo skúšané pomaly kokryštalizovať dusičnan GLY v rôznych mólových pomeroch (2:1, 1:1, 1:2) s NH4NO3, či tvoria taktiež podvojnú soľ. Výsledky sú zaujímavé - pri pomere 2:1 sa zdá, že väčšina kryštalickej masy je tvorená tými lístkami pripomínajúcimi sľudu, plus na povrchu vzlínavosťou roztoku (pod už vytvorenými kryštálmi) vznikli zdanlivo amorfné zhluky pripomínajúce mračná - tieto vznikli pri všetkých pokusoch, takže ďalej ich spomínať nebudeme. Roztoky sa nachádzali v plochých miskách. Pri pomere 1:1 sa v miske nachádzali stále očividne ploché kryštály, no už väčšinou podlhovasté. Pri pomere 1:2 vznikli pekné, hodvábne lesklé ihlicovité alebo prizmatické, či možno predsa len ploché, no úzke kryštály, na prvý pohľad pripomínajúce kryštály NH4NO3, ktoré sú ale v priemere menšie a veľmi krehké, dajú sa ľahko rozmrviť (kým kryštály dusičnanu amónneho sú veľmi tvrdé). Pri rýchlom ochladení tenkej vrstvy konc. roztoku 1:2, v plastovej nádobe, vznikne nános vejárovitých/hviezdicovitých zhlukov ihlicovitých kryštálov s hodvábnym leskom, na prvý pohľad pripomínajúce povrch pozinkovaného plechu. Príklad pomaly kokryštalizovaných dusičnanov (v pomere 1:2 DG:DA), okrem lesklých kryštálov vidno aj tie spomínané "mračná":
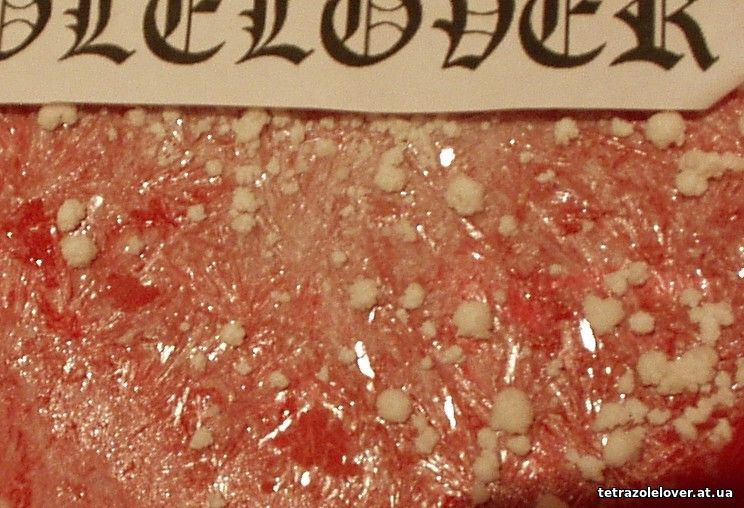
Zmes v rovnakom pomere kryštalizovaná v tenšej vrstve vytvára omnoho menej tých "mračien" samozrejme. Je ťažké povedať, či všetky kryštály majú podobnú štruktúru, mimo hodvávnych kryštálov akoby tam boli aj samostatné kryštály DA:

GlyHNO3 a NH4NO3 v určitom pomere tvoria podvojný dusičnan, čo je veľmi zaujímavá trhavina. Napr. na obrázku nižšie je rýchlo kokryštalizovaný dusičnan Gly s amónnym, tiež v pomere 1:2, čo je samozrejme stechiometrická zmes:

Táto praktická, citlivá a stabilná trhavina sa dá pripraviť jednoducho pridaním malého množstva vody (aby zmes bola len husto kašovitá) do zmesi dusičnanov, zohrievaním, až sa všetko rozpustí, potom miešaním a drobením zlepencov za pozvoľného ochladzovania až do vzniku sypkej látky (kryštalizačné teplo vypudí takmer všetku vodu).
Vedecký papier o GLYHNO3.
Chloristan (mono)GLY je ako trhavina značne výkonnejší než dusičnan, no je príliš hygroskopický:

To však nebráni jeho priamemu využitiu v trhavinách plastifikovaných vodou (respektíve jeho koncentrovaným roztokom, napríklad v kombinácii s tritolom a zahusťovadlom) a taktiež využitiu ako prekurzor na výrobu podvojných solí a experimentálnych energetických "živíc" a "skiel". DiGLY chloristan je taktiež zaujímavý, má síce o niečo nižšiu hustotu a samozrejme horšiu kyslíkovú bilanciu (ktorá je ale stále akceptovateľná), no je veľmi zle rozpustný v alkohole a acetóne, a je menej kyslý (pH 5 v koncentrovanom roztoku).
Chloristan kreatínu má celkom podobné vlastnosti ako chloristan GLY - tvorí neschnúce vodné roztoky, z tých sa ale po veľmi dlhom státí začnú vylučovať kryštály, no tie sú už, ako sme zistili, určite chloristanom kreatinínu, ktorý vznikol cyklizáciou a dehydratáciou kreatiníovej soli pri kyslom pH (v čerstvom roztoku hodnota 2, po dlhšion zohrievaní stúpa na 4 - 5, určite cyklizáciou, no vzniká zas len hustý "sirup". Pár hodín ohrevu na vodnom kúpeli je zdá sa málo pri nie ideálnej pH hodnote. A ako sme zistili, chloristan kreatínu je vysoko rozpustný aj v liehu, aj v acetóne. To, čo sa vyzráža z vodného roztoku po pridaní organického rozpúšťadla, je vždy už chloristan kreatinínu (respektíve aj nadbytok kreatínu, ak bol pridaný). Liehový roztok chlor. kreatínu (koncentrovaná HClO4 pridaná priamo do suspenzie kreatínu v liehu) po dvojhodinovom refluxe nedáva po ochladení zrazeninu. Po pridaní pol mólu CuO a niekoľkohodinovom refluxe sa oxid rozpúšťa veľmi pomaly a nerozpustí sa celý. Reakcia sa očividne zastaví po rozpustení určitého množstva oxidu a vznikne tmavo-tyrkysový roztok. Máme s týmto určité nápady. Vo vhodnom čase pridáme ďalšie informácie.
Skúsime aj vytvoriť zmesné/podvojné chloristany z tých, s ktorými pracujeme. Ak sa niečo podarí, možno produkt bude mať lepšie vlastnosti ako pôvodné zložky, alebo jedna zložka, napr. nižšiu hygroskopicitu a vyššiu hustotu. Spomenutým zlúčeninám sa budeme postupne trpezlivo venovať ďalej. Na ďalšom obrázku nižšie je napr. chloristan DiGLY, ktorý sme sa neúspešne pokúsili rozpustiť v horúcom etanole a acetóne (pri príprave takýchto chloristanov alebo dusičnanov používame mierny nadbytok zásaditej látky, kedže tá už môže mať vďaka vzdušnej vlhkosti nižšiu koncentráciu, ale hlavne aby vyrobená zlúčenina neobsahovala voľnú kyselinu, ktorá vysoko zvyšuje hygroskopicitu produktu a samozrejme extrémne a nebezpečne kyslosť), či zostane nejaký voľný GLY, ktorý by sme oddelili. Rozpúšťadlo sme nechali odparovať vonku jeden deň, pri pomerne vlhkom počasí, no ako to vidno na obrázku, soľ sa "neroztiekla":

Soľ by sa určite celá rozpustila v značne väčšom množstve horúceho rozpúšťadla, no už aj teraz to bolo plytvaním. Chloristan bol potom ešte raz prepláchnutý liehom a vysušený. Vzhľad suchej soli:

Chloristan DIGLY je značne necitlivá látka. Nepoužiteľná v rozbuškách a dokonca nedetonovala ani od malej pentritovej rozbušky.
Energetické vlastnosti napríklad má nepochybne aj taktiež jednoducho pripraviteľný a stabilný komplex GLY s NaNO3 (obsahuje rovnaké množstvo využiteľného kyslíka ako dusičnan GLY), ktorý má potenciálne využitie ako nelineárny optický materiál a o ktorom sa už toho tiež dosť napísalo, napr. tu: 1, 2. Bolo skúšané ho detonovať, v množstve 70g, rozbuškou s 0,8g pentritu (+0,2 g Cu diazoaminotetrazolátu v nábojnici .223 Rem), no neúspešne. Bol len v sáčku, neuzavretý.
Dávno známy je aj komplex chloristanu strontnatého s tromi mólami GLY: US3296045, ktorý sme taktiež pripravili, aby sme otestovali jeho detonačné vlastnosti. 45 gramová prášková vzorka bola pre istotu zmiešaná s hliníkom (5%, lístkový), aby bolo istejšie, že detonuje v takomto množstve od rozbušky (na báze BAGNP, PETN a TNT) a takisto aby bol záblesk viditeľnejší v prípadných nevhodných podmienkach, čo aj bol. Náložka detonovala očividne dobre, látka je celkom schopná nie len pre použitie vo svetliciach a ohňostrojoch. Lepšie vlastnosti by mal mať podobný chloristan tris(glycín) vápenatý, podľa všetkého nikde zatiaľ nespomínaný, ktorý sa nám podarilo pripraviť v suchej práškovej forme. On, na rozdiel od strontnatej zlúčeniny, je veľmi citlivý na plameň a prudko deflagruje, no v rúrkach len zhorí, deflagrácia neprejde do detonácie. Nie je hygroskopický. No pripravili sme aj "vylepšenú" zlúčeninu - s len dvomi mólami glycínu. Vychádzali sme z toho, že chloristan Ca je za bežných podmienok tetrahydrát, takže by možno nebol problém udržať komplex s dvomi mólami GLY bezvodý, alebo v horšom prípade ako monohydrát. Látka, ktorú sme získali, určite nie je zmes hydratovaného chloristanu Ca s komplexom s 3xGLY a taktiež pravdepodobne neobsahuje viazanú vodu - je extrémne ľahko zápalná a deflagruje ešte značne prudšie a s väčším plameňom, než komplex s 3xGLY, nenastáva žiadne viditeľné oneskorenie pre prvotné "schnutie", či topenie. Ako trhavina sama nie je preto bezpečná, možno po zmiešaní s plastifikátorom klesne jej zápalnosť, pričom by bola ešte detonovateľná rozbuškou, v to dúfame. Po ďalších testoch sa uvidí. Zlúčenina by mala byť značne výkonná, keďže by sa dala chápať ako chloristan glycínu zriedený, ale zároveň aj zahustený (zvyšuje hustotu) pol mólom vápnika, pričom vápnik je aj výhodným požieračom chlóru. Rovnako to platí pre komplexy glycínu s chloristanom horčíka. Je to až neuveriteľné, ale 3 móly GLY taktiež tvoria nehygroskopický komplex aj s chloristanom Mg (látku sme začali žartovne nazývať "porazený anhydrón"). Látka má ešte vyšší obsah energie, ale teoreticky nižšiu hustotu ako Ca komplex. S hliníkom by to mali byť skvelé termobarické náplne, čo aj postupne zisťujeme, že sú. Aj takýmto smerom sa dá uberať vo vylepšovaní a "podvádzaní" negatívnych vlastností niektorých energetických materiálov. Videá pribudnú ďalšie. Ak by tvoril bezvodý 1:1 komplex s glycínom (čo asi nie), tak možno ešte lepšie vlastnosti by mal Li komplexný chloristan.
Pre zaujímavosť, napr. aj nepraktický komplex GLY s AgNO3 môže byť značne energetický (zopár vedeckých papierov o ňom 1, 2, 3, 4):

Okrem známejších komplexov GLY s dusičnanmi NH3, Na a Ag, sú popísané aj iné:
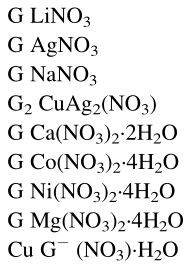
Ale napr. aj niektoré kobaltité komplexné zlúčeniny môžu byť zaujímavé z pohľadu ich možných energetických vlastností:


Takisto aj napr. chloristan železitý tvorí s aminokyselinami zaujímavé zlúčeniny a dokonca komplex s tryptofánom sa ukázal byť nebezpečný po státí na svetle: Preparation and Properties of Fe3+-Amino Acid Complexes, Preparation and Properties of Iron(III)-Amino Acid Complexes. 2. The Crystal and Molecular Structure of Monoclinic Tri-μ3-oxo-triaquohexakis(glycine)triiron(III) Perchlorate, PREPARATION AND PROPERTIES OF TRINUCLEAR OXOBRIDGED IRON(III)-L-AMINO PERCHLORATES: AMINOACIDS WITH REACTIVE R GROUPS. Podobné komplexy s dusičnanovým aniónom: Preparation and Properties of Iron(III )--L-Amino Acid Nitrates.
Na internete sa nájsť dosť veľa vedeckých papierov o nových komplexoch GLY s anorganickými soľami (hlavne určených pre použitie v laserovej technike), z ktorých niektoré majú nepochybne aj energetické vlastnosti, no treba tu uviesť jedno upozornenie:

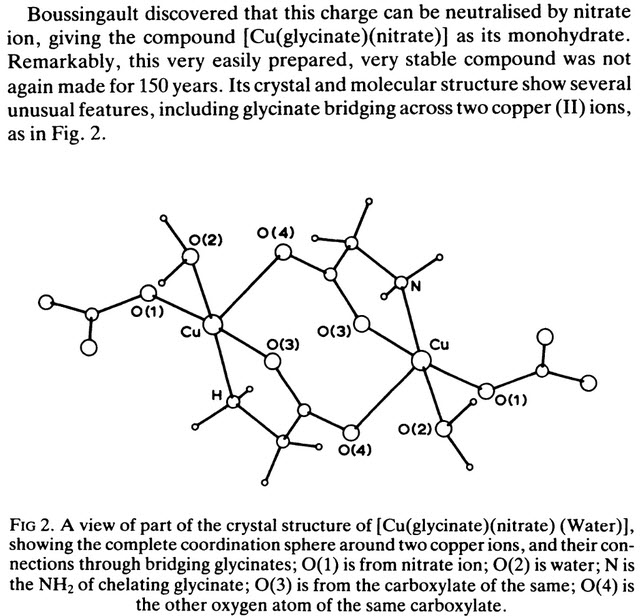
V tomto príspevku však budú rozoberané menej známe zlúčeniny GLY, hlavne komplexy alebo podvojné soli. Napr. sú známe podvojné soli Cu (GLY)2 s dusičnanom či chloristanom meďnatým:




GLY-dusičnan meďnatý sa dá pripraviť očividne v dvoch formách - tmavomodrý kryštalický, pri pomalom odparovaní roztoku, a jemný, púdrovitý, svetlej azúrovej farby, pri rýchlom ochladení horúceho koncentrovaného roztoku, napr. z kašovitej zmesi oxidu meďnatého a dusičnanu GLY (1/1) po zohriatí, tak bola pripravená vzorka na obrázku nižšie. Je ale možné, že sú to dve rozdielne zlúčeniny - aj pri pomalom odparovaní roztoku farby "kráľovskej modrej" od určitej koncentrácie sa nakoniec často vyzráža tá svetlomodrá látka (ktorá sa ale dá vo vode opäť rozpustiť na pekný tmavomodrý roztok ale látka niekedy obsahuje prímes aj čistého tmavomodrého gly-dusičnanu, ktorý vykryštalizuje neskôr, samostatne). Zdá sa, že sa to stane už pri malom nepomere prekurzorov (CuO a GlyHNO3) alebo pri znečistenom CuO (bol pripravený z technického CuSO4.5H2O). Zatiaľ to nie je celkom jasné. Možno je to zásaditý gly-dusičnan alebo nejaký iný komplex, či zmes viacerých zlúčenín, no najskôr to bude len iná kryštalická modifkácia gly-dusičnanu - látka vôbec nie je hygroskopická. Preto je treba sa vyvarovať nadbytku oxidu/hydroxidu Cu, čo je však niekedy problém, pri neznámej čistote prekurzorov. Postupným pridávaním dusičnanu GLY k roztoku/suspenzii tej svetlej látky sa nakoniec dá získať tmavomodrý produkt, ale je to problematické. Očividne priama reakcia GlyHNO3 a oxidu/hydroxidu Cu nie je výhodná, pre čistý produkt je najlepšia priama reakcia aminooctanu Cu so studeným roztokom dusičnanu Cu. Reakcia dvoch látok v plameni/pri pomalom zohrievaní je tiež rozdielna - svetlomodrá má minimálne energetické vlastnosti, kým tá tmavá buď kľudne deflagruje, alebo zabalená v pár vrstvách alobalu slabo vzbuchne.

Taktiež ho bolo skúšané detonovať, tiež neuzavretý, v množstve 18g, rozbuškou s 0,35g pentritu a 0,2g Cu diazoaminotetrazolátu, v plastovej rúrke a takisto aj v množstve 10g, mosadznou rozbuškou s podobnou náplňou,, pod vrstvou zeminy, no v oboch prípadoch neúspešne. Taktiež v zmesi s NH4NO3 50/50 bola dosiahnutá najviac ak čiastočná detonácia - je to až takmer neuveriteľné, ak zoberieme v úvahu ochotu detonovať dvoch príbuzných podvojných solí: GLY-chlorečnanu a GLY-chloristanu meďnatého (ale to bola zatiaľ testovaná len tá svetlomodrá forma). Veľmi zaujímavé nformácie nižšie.
GLY- chlorečnan i -chloristan Cu majú v uzavretom priestore veľkú ochotu prejsť z deflagrácie v detonáciu (alebo neuzavreté ochotne detonujú aj od malého množstva inej traskaviny). GLY- chloristan ako energetický materiál bol asi prvýkrát testovaný na východnom Slovensku a GLY-chlorečnan meďnatý je podľa všetkého východoslovenský vynález. Chlorečnan sa zdá byť vo vlhkom stave stabilný, takže sa dá bezpečne a bez znehodnotenia skladovať (zatiaľ v štádiu testov!), takisto ako chloristan, dokonca ani viacnásobným odparovaním roztoku na vriacom vodnom kúpeli nenastáva žiadny rozklad. Je to asi taktiež jeden z mála v praxi použiteľných energetických chlorečnanov. Štipka soli v alobale od zápalnice pomerne hlasno ale nie ostro exploduje, no alobal len roztrhne, kým aj omnoho menšie množstvo, tiež zabalené do pár vrstiev alobalu, pri pomalom zohrievaní nad ohňom ostro exploduje a alobal je roztrieštený na veľké množstvo malých kúskov. To isté spraví aj chloristan, kým od zápalnice len prudko deflagruje (uzavretý v tenkej vrstve alobalu). Obe voľne zapálené soli deflagrujú, chloristan neochotne - od kontaktu s plameňom ochotnejšie a prudšie, ako len od kontaktu s rozžeraveným predmetom, chlorečnan je dosť nepredvídateľný, ale voľne na vzduchu neexploduje (aspoň v malých množstvách), čo je samozrejme veľmi výhodné. Ich nevýhodou je ľahká rozpustnosť vo vode. Ich vzhľad (použité rýchle odparovanie roztoku):


Obe soli dokonale fungovali v improvizovaných rozbuškách. Najprv boli testované menšie množstvá, či vôbec prerastie deflagrácia v detonáciu v tenkej vrstve na dne nábojníc od horiacej pyro zlože, napr. 0,2g, explózie boli veľmi silné, chorečnan má lepšiu akceleráciu (vzhľadom k ešte neistému zloženiu týchto zlúčenín), no ten aj bol pripravený z čistejších surovín:

Gly-chloristan meďnatý sa zdá byť perspektívnym, futuristickým energetickým materiálom na plnenie jednozložkových rozbušiek (neobsahujúcich oddelenú primárnu a sekundárnu náplň), ktorý nepadne ľahko do zabudnutia (to ani chlorečnan, no ten je predsa len menej bezpečný).
Bol spravený rýchly test trieštenia nábojníc, na porovnanie s pentritom. Pentrit má samozrejme väčšiu brizanciu, a Cu-GLY-chloristan sa nachádza niekde na pomedzí medzi traskavinami a trhavinami, takže nemá rýchly rozbeh, pravdepodobne veľká časť zlúčeniny len deflagrovala, ale predsa (všimnite si jemný medený povlak na zbytkoch vľavo):

To DAAzTz je v rýchlosti chybne napísané označenie pre diazoaminotetrazolát.
Keďže Cu-GLY-chlorečnan je slovenský vynález a môže byť potenciálne, či už nebezpečný, alebo naopak, jeden z chlorečnanov v praxi použiteľných, prvé testy sú sústredené naň. Bolo ním napr. skúšané v plastovej rúrke iniciovať PETN, v množstve 0,15g, úspešne. Zdá sa, že je celkom schopný. Minimálne iniciačné množstvo pre pentrit stále neznáme. Na plechovke bola urobená preliačina, položená rozbuška a voľne odpálená (náplň v rozbuške siahala do menej ako polovice dĺžky rúrky, zbytok bol vyplnený natlačeným papierom):


V rovnakej rúrke (asi polyetylén, priemer circa 7-8 mm, stena asi 1 mm, koniec pre zápalnicu priemer cca 2 mm, z druhej širokej strany natlačené trochu papiera a obtočené gumovou páskou) bolo pre začiatok skúšané iniciovať Cu-GLY-chloristan (zatiaľ nelisovaný). Bolo predpokladané, že od slabého bodového zdroja tepla a v slabom obale chloristan len deflagruje a rozbuška sa zmení na malú raketu alebo len slabo vzbuchne, no výsledok bol pomerne prekvapujúci. Rozbuška silno a ostro explodovala, očividne nie s veľkou brizanciou. Na plechu, ktorý bol po ruke a bol položený pod rozbušku, s hrúbkou asi 0,3-0,4 mm, zanechal takúto priehlbinu (na začiatok nie zlé, uvidí sa po použití iného obalu či priemeru, a s rôznym lisovaním):



Potom bolo testované 0,4 g voľne sypaného Gly-chloristanu v papierovej rúrke s priemerom cca 8 mm, vytvorenej z pár závitov kancelárskeho papiera. Koniec pre zápalnicu bol pokrčený a obtočený gumovou páskou, druhý koniec upchatý kúskom natlačeného papiera a taktiež obtočený páskou. Taký istý použitý druh plechu bol predtým mierne prehnutý, aby sa rozbuška neskotúľala, zápalnica vytvára mierny ťah a dokáže pohnúť ľahšími predmetmi. Zlúčenina očividne nemá až tak zlý rozbeh v slabých obaloch:




Ďalej bola zlúčenina testovaná v hliníkovej dutinke s rozmermi pôvodne totožnými so ženijnou rozbuškou Ž (ale bez rozbuškovej poistky). Zlúčenina bola v rozbuške ručne silno lisovaná (spodná časť), v množstve 0,25 g / voľne sypaná, tiež v množstve 0,25 g. Dutinka bola okolo zápalnice opatrne stlačená, aby sa zápalnica nepohybovala a lepiacou páskou zvisle pripevnená k plechu:





Niet pochýb, GLY-chloristan je použiteľný v rozbuškách typu NPED.
Ako v predchádzajúcom experimente, bola skúšaná rozbuška, ale z rúrky urobenej z pár závitov kancelárskeho papiera s vnút. priemerom 6 mm, s náplňou 0,2 g mierne lisovaného Gly-chloristanu (pri silnom lisovaní by sa rúrka roztrhla), na vrchu s voľne sypaným, tiež 0,2 g. Vrch bol pokrčený a obtočený gum. páskou, na spodku bol prilepený kúsok papiera. Rozbuška bola tiež odpálená zvisle. Explózia bola silná, no plech bol len prehnutý.
Budú spravené testy mechanickej citlivosti (zatiaľ v trecej miske sa chlorečnan zdá byť málo citlivý - potreskúval len pri silnom roztieraní a obe látky na roztieranie na organických podkladoch vôbec nereagovali, vďaka hydrátovej vode, ktorá znižuje ich citlivosť, ale tak či tak treba byť s nimi VEĽMI OPATRNÝ, hlavne s chlorečnanom, na úder je pomerne citlivý) a testy v iných obaloch, rozmeroch a množstvách...
Testy stability sú robené vo veľmi vlhkom lesnom prostredí, zlúčeniny sú v ľahko uzavretých plastových nádobách, okolo ktorých môže voľne tiecť voda. Po viac ako mesiaci skladovania nebadať žiadne zmeny. Po dažďoch mierne navlhli, kryštalický prášok sa zlepuje, no stále si látky zachovávajú akú takú sypkosť. Do nádobky s chlorečnanom vošlo aj zopár kvapiek vody, no nerozpustil sa a nemá žiadny zápach (suchý začne mať po určitom čase "chlórový" zápach, takže ho pre istotu treba skladovať vlhký, pred použitím vysušiť a spotrebovať v najlepšie v priebehu niekoľkých týždňov).
Po niekoľkých mesiacoch sa v oboch nádobkách kondenzovali kvapky vody, obe soli navlhli a vytvorili hustý zlepenec, no stále sa nerozpustili na kvapalinu. Iná vzorka gly-clorečnanu je rozpustená vo vode a ponechaná, aby sa voda voľne odparila, to sa potom opakuje. Tiež nebadať zmenu (ale ak sa ponechá dlhšiu dobu suchý, začína mať zápach). Na obrázku nižšie je vzorka GLY-chlorečnanu ponechaná v lese, v plastovej škatuľke, 6 mesiacov. Vizuálna zmena žiadna, ak nepočítame trochu skondenzovanej vody, absolútne žiadny zápach: Potom bola vzorka Gly-chlorečnanu premiestnená na iné, menej vlhké miesto, no v zime dosť, a opäť skontrolovaná po cca 6. mesiacoch (vzorka je rok stará!). Vzorka vyzerá byť absolútne bez zmeny a bez zápachu. Čiže s najväčšou pravdepodobnosťou sa rozložila iba nejaká prímes, nečistota. Citlivosť na úder je vysoká - kúsky explodovali od miernych úderov (kameň/kameň), na trenie málo (rovnaké podmienky). Podľa zvuku malé častice mali tendenciu prechádzať z deflagrácie v detonáciu ak boli hoci len mierne prekryté napr. žeravým uhlíkom. Niet pochýb, je to kvalitná traskavina.

Toto je zas vzorka po roku:

Improvizovanými NPED rozbuškami s náplňou aminooctanu-chloristanu meďnatého boli úspešne iniciované 15 - 50g náložky amonalov a zmesí dusičnanu GLY s NH4NO3 (mienené ako počinové náložky pre "slurries"). Rozbušky boli použité podobné týmto (z nábojníc .223 Rem - pretože boli k dispozícii vo veľkom množstve zdarma. Dná boli odpílené a po naplnení konce zaliate roztokom nitrocelulózy):

Momentálne - rok 2019, sa testujú plastové rozbušky. V rozbuškách z nábojníc dochádzalo k veľkému plytvaniu zlúčeninou, aj kvôli veľkému priemeru ale aj pre priamu iniciáciu nelisovanej časti zlúčeniny zápalnicou. Výhodnejšie sa javí používať menšiu náplň, ktorá je lisovaná celá a detonáciu v nej vyvolať pomaly horiacou, dym nevyvíjajúcou zložou, napr. zmesou CuO a Zn.
Skúšaju sa rozbušky plnené či len gly-chloristanom, ale aj v kombinácii s pentritom, tritolom (s týmto v rúrkach s väčším priemerom) a hexanitrostilbénom. Taktiež bolo zistené, že Gly-chloristan Cu má veľmi silný senzibilujúci účinok pre málo citlivé amónoliadkové trhaviny aj v nepatrných množstvách (stanú sa citlivé aj na iniciáciu značne slabými rozbuškami). Otázne je, do akej miery sa v kontakte s (vlhkým) NH4NO3 vytvorí Gly-dusičnan Cu a NH4ClO4 (citlivosť zvyšujú možno nakoniec tieto zlúčeniny). Ale aj zmes gly-chloristanu s pár percentami hliníka sa javí veľmi výhodná (pri absencii vlhkosti), má očividne veľmi rýchly rozbeh v tenkostenných, poddajných rozbuškách.
Vyzerá to tak, že pravdepodobne aj gly-chloristan vytvára dve kryštalické modifikácie, hrubšiu tmavomodrú a mikrokryštalickú svetlomodrú, no je možné, že sa líšia obsahom vody.
Bolo skúšané aj kokryštalizovať dva móly chloristanu meďnatého s jedným mólom glycinátu. Po dlhom zohrievaní roztoku sme nakoniec získali modrý suchý prášok (badateľne len zmes GLY-chloristanu s niektorým z hydrátov chloristanu), extrémne hygroskopický, samostatne deflagrujúci veľmi neochotne ale silno podporujúcim horenie. Pri experimente s mólom chloristanu GLY a 1/4 mólu Cu2(OH)2CO3, sa nám taktiež, na naše potešenie, podarilo získať suchý modro-sivasto-zelenkastý prášok, ktorý bol samozrejme taktiež hygroskopický, no v suchom stave by mal byť výkonnou trhavinou. Pri kontakte s plameňom deflagruje hlasno, ale nespoľahlivo. Pravdepodobne je to tiež len zmes chloristanu GLY a Cu GLY-chloristanu, alebo komplex Cu chloristanu s dvomi mólami GLY.
Niektoré papiere súvisiace so spôsobom prípravy vyššie spomínaných, meďnatých podvojných solí a taktiež s možnosťou náhrady vody v molekule iným ligandom (to bude ešte viac testované neskôr):
Bolo skúšané aj kokryštalyzovať mól nitrotetrazolátu Cu, mól chloristanu Cu a dva móly aminooctanu Cu, no po ochladení horúceho roztoku sa vyzrážali minimálne dve zlúčeniny (gly-chloristan je hneď rozpoznateľný, no nie je isté, či Cu(NT)2 vytvoril podvojnú soľ, no zlúčenina/zmes pri pomalom zohrievaní taktiež silno exploduje). Po pridaní čpavku do roztoku Gly-chloristanu sa soľ rozpadne, čpavok nenahradí vodu v molekule, je veľmi zásaditý. Po pridaní biuretu - toto bolo skúšané pre potenciálne zníženie rozpustnosti produktu (ktorý by ale možno bol stále iniciovateľný detonáciou), 1/1, sa vylúčia taktiež minimálne dve zlúčeniny, no zdá sa, že aspoň časť je pôvodná soľ, druhá, veľmi svetlá, malé ihličky, by mohol byť primiešanou soľou zafarbený nezlúčený biuret alebo klasický, svetlo sfarbený bis(biuret) komplex (bolo predpokladané, keďže soľ kryštalizuje s jednou molekulou vody, že neprijme až dve molekuly biuretu). Zmes v ohni tiež deflagrovala dosť prudko. Teraz už vieme, po skúsenostiach s chloristanom bis(biuret) meďnatým, že takto sa asi vôbec nedajú pripraviť čisté komplexy biuretu so zlúčeninami obsahujúcimi meďnatý katión a chloristanový anión. Taktiež bolo skúšané vytvoriť komplex s 5-aminotetrazolom, keďže je len mierne kyslý a je taktiež schopný v molekule chloristanu meďnatého hexahydrátu stabilne nahradiť všetky molekuly vody. Bol pripravený roztok Cu GLY-chloristanu (reakciou horúceho roztoku GLY-chloristanu s nepatrným nadbytkom oxidu meďnatého, 1:1) a doň bol po vychladnutí pridaný 5-aminotetrazol monohydrát (pripravený neutralizáciou dusičnanu 5-aminotetrazolu do pH 4), v pomere 1:1. Rozpúšťaniu 5-ATZ ale bránila hneď na povrchu vznikajúca zelená zrazenina, zmes bolo treba poriadne miešať a zelené zlepence "rozbíjať" plastovou tyčinkou. Vznikla až takmer kašovitá tmavozelená zmes. Na obrázkoch nižšie je pôvodný roztok GLY-chloristanu a potom po pridaní 5-ATZ:
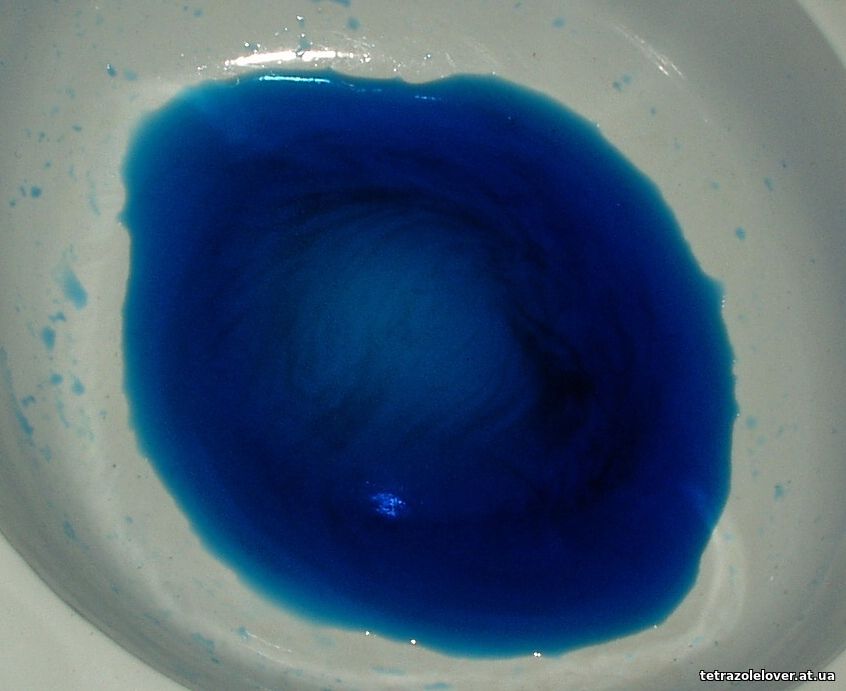


Chceli sme vedieť, či nad zelenou usadeninou bude modrý roztok (čo by s najväčšou pravdepodobnosťou signalizovalo rozpad molekuly GLY-chloristanu na 1/2Cu(5-ATZ)2, 1/2Cu(ClO4)2 a GLY) no až po zriedení a zohriatí suspenzie na vodnom kúpeli sa zelená zlúčenina začala usadzovať, pričom jej objem sa veľmi zmenšil. Roztok nad zrazeninou bol modrý:

Z roztoku aj s usadenou zrazeninou nechávame pomaly odparovať vodu, či na povrchu zrazeniny vykryštalizuje iná zlúčenina alebo či zmes zostane stále vlhká, hygroskopická. Potom časť zmesi skúsime povariť v horúcom liehu alebo acetóne, či nastane výrazná zmena a časť priamo zohrejeme na vodnom kúpeli, či tavenina hydrátov chloristanu Cu a glycínu (vlastne ich komplex) rozpustí 5-aminotetrazolát Cu (ak vo vode nastal rozpad na tieto zlúčeniny). Po pár dňoch sa väčšina vody odparilla a ako ani nič kryštalického zreteľne nebadať, tak ani príliš modrého nezostalo. Na kraji modrého roztoku s usadenou zelenou zrazeninou sa vytvoril už suchý, priehľadný, pružný, ale krehký a ľahko sa odlupujúci tmavozelený film:


Kúsky v plameni energicky deflagrujú, mimo plameňa hasnú. Bude zaujímavé sledovať, či sa ešte postupne státím zmení vlhká časť zelenej zrazeniny v miske. Po pár hodinách sa zdá, že všetok obsah misky nakoniec vyschol, absolútne nebadať prítomnosť niečoho vlhkého, stále rozpusteného a to sme predpokladali prítomnosť hygroskopických produktov rozkladu GLY-chloristanu Cu. Hmota v strede misky sa rozpadla na malé krehké zlepence, na vrchnej strane veľmi tmavé, odspodu zelené. Jediné miesto kde ako-tak badať modrú farbu je, kde pôvodne siahala hladina roztoku. Vznikli teda minimálne dve zlúčeniny - zelené zlepence tvorené hlavne 5-aminotetrazolátom medi a pravdepodobne komplex chloristanu medi s glycínom (časť glycínu mohol prijať aj aminotetrazolát), ktorý sa zdá, je pri určitej vlhkosti buď schopný rozpúšťať 5-aminotetrazolát Cu alebo dokonca s ním reagovať a nie je veľmi hygroskopický (vzorka bola dva dni ponechaná vo vlhkom počasí vonku, čiastočky sa začali k sebe slabo lepiť, ak sa s nimi chvíľu nepohybovalo, no zmes bola stále sypká, neskôr, keď sa počasie zlepšilo, vzorka bola opäť suchou). Budú musieť byť vykonané ďalšie experimenty. Na obrázku nižšie je vyschnutý obsah misky:

Pred rokmi sme skúšali vytvoriť komplexy (nie podvojnú soľ) chloristanu meďnatého s GLY. Produkty boli nekryštalizujúce hmoty rôznej konzistencie, váčšinou stále vlhké alebo hygroskopické, teda pri daných pomeroch zlúčenín, ich čistote a podmienkach v akých sme pracovali. Akosi nás nezaujímali, bažili sme po kryštalických, sypkých, vo vode málo rozpustných látkach. Teraz, ako nás zaujímajú ešte atypickejšie, laditeľné energetické materiály, budeme musieť svoje pokusy zopakovať.
Keď sme pri zelených zlúčeninách, bola vyskúšaná aj reakcia horúceho vodného roztoku GLY chloristanu s hydroxyuhličitanom nikelnatým. Vznikol tmavozelený, vlastne skôr tmavozelenomodrý roztok, státím na vzduchu "neschnúci", zohrievaním na vodnom kúpeli postupne hustnúci na viskóznu hmotu, po ochladení meniacu sa na krehké sklo (podobne ako nižšie spomínaný meďnatý komplex s DAA, v skutočnosti by sa tieto látky, zdá sa, zmenili na sklo ešte za zohrievania, no trvalo by to dlhšiu dobu a v obsahu vody by asi príliš veľký rozdiel nebol) zelenej farby. Prášok z tohto skla deflagruje v plameni energicky ale neochotne, istotne stále obsahuje veľa vody. No výsledná hmota je príliš ľahko rozpustná v acetóne a po odparení acetónu látka už má medovitú konzistenciu. Vzorka pomrveného "skla" rýchlo prepláchnutá acetónom a ponechaná na vsiakavom papieri sa na vzduchu tiež rýchlo mení na viskóznu kvapalinu, no papier žiadnu vodu z kvapky nevsiaka, je vlhký len pod ostro ohraničenou kvapkou hmoty, ktorá na vzduchu opäť začína tuhnúť, takisto ako aj vzorka ponechaná v plastovej miske. Ich konzistencia zatiaľ pripomína tuhnúcu epoxidovú živicu. Po prenesení do vlhkého prostredia sa konzistencia opäť zmení na redšiu medovitú, zo vzorky na papieri sa však do papiera nevpíja žiadna ďalšia kvapalina a tak to vyzerá, že ani pri vyššej vlhkosti, keď sa hmota zmení už na hustšiu kvapalinu, nebadať známky rozkladu, kvapalina je číra a má opäť tendenciu rýchlo hustnúť vo vhodnom prostredí, ba dokonca takmer alebo aj úplne vytvrdnúť na krehké sklo počas teplého, suchšieho dňa, čo je ozaj vynikajúce. Papier nasiaknutý touto látkou je potom ľahko lámavý. Na fotkách nižšie je vodný roztok a "sklo" vyššie spomínané:
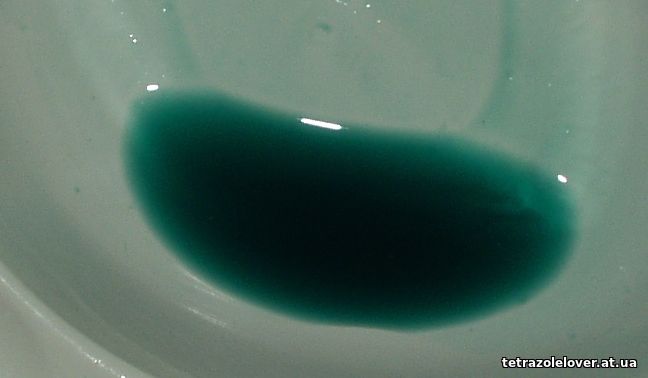

K časti látky sme priliali nadbytok čpavkovej vody, predvídateľne sa vyzrážala fialová látka, s najväčšou pravdepodobnosťou len amoniakát chloristanu Ni a nad ňou sa vytvoril modrý roztok, logicky rozpustený amoniakát Ni(GLY)2, ak existuje, ale po pár hodinách sa fialová zrazenina opäť rozpustila, zostal len modrý roztok, pričom ten má stále zreteľný čpavkový zápach. Je to zaujímavé, uvidíme čo sa bude diať s postupným odparovaním čpavku a vody. Obrázky toho modrého roztoku (roztok je mierne mútny od nadbytku hydroxyuhličitanu Ni pre spoľahlivú neutralizáciu kyselín):
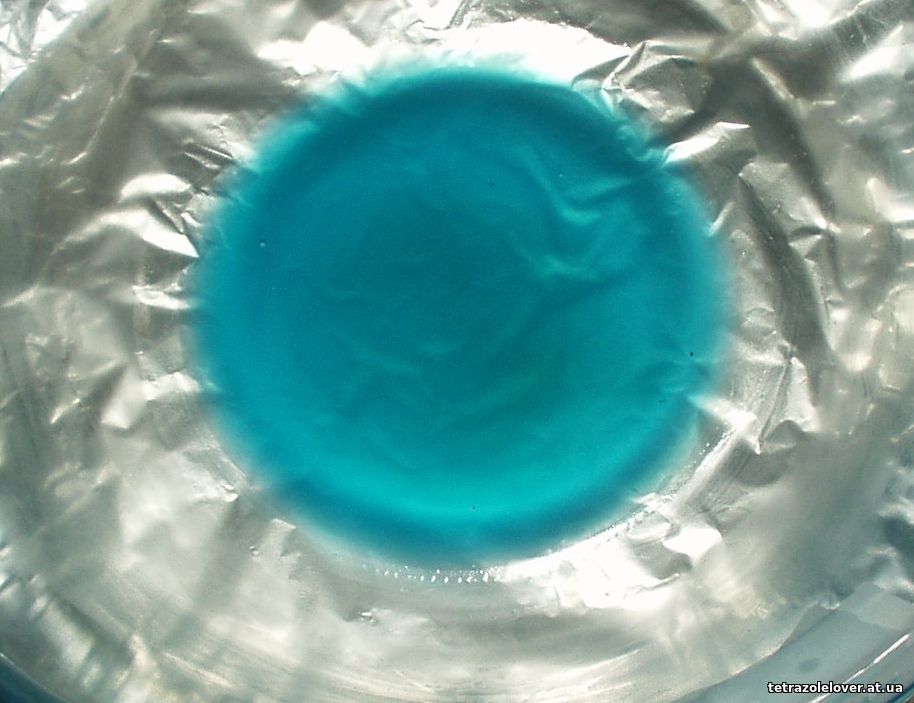

No potom prišiel pesimizmus, ako sa po odparení väčšiny vody objavilo v hmote veľké množstvo asi bezfarebných kryštálikov, s najväčšou pravdepodobnosťou chloristan amónny. Modrý hustý zbytok by mohol obsahovať nejaký amminkomplex hydroxy-aminooctanu Ni. Zmes už nepáchla čpavkom, ani po zohrievaní. V horúcom liehu ani v acetóne tá modrá hmota rozpustná nebola ani sa neoddeľovala od skla, preto sme do misy priliali trochu vody, ako sa zmes zas začala rozpúšťať, objavil sa čpavkový zápach. Roztok bol potom opäť zohrievaný, no farba zostala podobnou modrou do takmer úplného vyschnutia a aj čpavkový zápach sa držal dlho. Potom do hustej zmesi bol opäť pridaný lieh, či nastala zmena, no žiadne rozpúšťanie, azda len tá bezfarebná zlúčenina sa mierne rozpúšťala. Na fotkách nižšie je takmer vyschnutá pôvodná, amoniak obsahujúca zmes s vylúčenými kryštálmi a potom už bielo-modrá zmes po pokusoch s rozpúšťaním:

Tá zmes bieleho prášku s modrou hmotou reagovala v ohni zaujímavo. Ak sme skúsili k bielej látke priložiť horiace drievko, skôr ho hasila a vyzeralo to tak, že práve tá modrá hmota reagovala energicky - v ohni nastávali nepravidelné, no aj pomerne silné vzbuchy. Čiže chloristanový anión sa nachádza skôr v tej modrej látke...
S bizmutitým katiónom sa dajú pripraviť podobné zaujímavé a ľahko taviteľné alebo schnúce a nehygroskopické zlúčeniny. Napr. zohrievaním roztoku chloristanu GLY s oxidom bizmutitým na vodnom kúpeli, kým sa nadbytok vody odparí, oxid rozpustí a suspenzia sa zmení na olejovitú taveninu/roztok. Ďalším zohrievaním je možné získať tuhé látky. Podľa množstva pridaného oxidu, vzhľadom k teoretickému Bi2(GLYClO4)3, od nedostatku až po nadbytok, pravdepodobne vznikajú buď GLY komplexy chloristanu Bi, normálna soľ až bizmutylové soli a ich rôzne vzájomné zmesi. Najprv sme vyskúšali prípravu hypotetického Bi2(GLYClO4)3. Suspenziu oxidu bizmutitého v roztoku chloristanu GLY sme zohrievali kým skrz rozpustenie, zhusťovanie a schnutie vznikla biela hmota, ktorá nevyzerá byť hygroskopická:

Pokusne sme látku otestovali v improvizovanej rozbuške z mosadznej rúrky s vnútorným priemerom 7 mm. Bola veľmi podobná týmto. Bola vyrobená v nevhodných podmienkach, nemali sme pri sebe váhy. Zlúčenina, ktorá v rozbuške bola len jemne lisovaná (len aby nebola sypká), bola iniciovaná "štipkou" chloristanu bis(agu) nikelnatého. Detonácia očividne nastala, kompletná, nezostal ani náznak zvyškov pôvodnej látky (na obr. nižšie sú iba najväčšie úlomky rozbušky, ale väčšina):

Rozbuška bola odpálená v tejto prázdnej CO2 fľaši, čo je veľmi dobrý spôsob zisťovania a porovnávania brizancie náplní a taktiež ich kritických hustôt a priemerov. Zlúčenina taktiež kompletne detonovala v plastovej 1.5 ml ampulke iniciovaná 40 mg Ni bis(agu) chloristanu a 50 mg pentritu (oddeľovacia vrstva). Samotná zlúčenina po zapálení deflagruje pomaly a malé množstvo zabalené v hliníkovej fólii a hodené do ohňa slabo vzbuchne s jasným modrým zábleskom. Na trenie je veľmi málo citlivá (dá sa bezbečne roztierať v trecej miske na jemný prach), možno bude vhodná ako alternatívna sekundárna náplň rozbušiek. Uvidíme po ďalších testoch (detonácia a citlivosť po silnom lisovaní a taktiež schopnosť iniciovať amonoliadkovú trhavinu).
Náhľad do reakcie hydroxidu bizmutitého s glycínom vo vodnom prostredí poskytuje tento patent: Bismuth Salts and their preparation GB816300A,v ktorom sú zlúčeniny pripravené podobne, ako bola pripravená naša. A zas v patente Bismuth-based energetic materials (patent US20160280614) si autor spomínaných energetických materiálov vybral kyselinu chloristú, ako najlepšie rozpúšťadlo bizmutitého prekurzoru. Keď si to spolu vezmeme, možno sa naozaj dá takto ľahko pripraviť Bi2(GLY-ClO4)3, ale taktiež je zatiaľ otázne, či sa dá pripraviť bezvodý, alebo či si trvalo drží nejakú vodu aj pri ohreve tesne pod teplotou 100°C. V určitej fáze jeho prípravy má aj konzistenciu redšieho cesta alebo tmelu, no je zatiaľ taktiež otázne, či detonuje aj pri (takmer) maximálnej hustote, "liaty" a vytvrdnutý. Viac neskôr.
Aj aminokyseliny, respektíve ich meďnaté soli, ktoré zatiaľ vo vedeckých papieroch neboli spomenuté v súvislosti s tvorbou podvojných solí s chloristanom alebo dusičnanom meďnatým, sú v určitých podmienkach schopné ich tvoriť. Napríklad podvojná soľ na báze DAA. Je to s ňou podobné, ako s biuretom a chloristanom meďnatým - vo vodnom roztoku chloristanu Cu neprebieha reakcia alebo naopak, hotová komplexná soľ sa pri kontakte s vodou okamžite rozkladá. Takisto aj horúci roztok chloristanu DAA ľahko rozpustí oxid meďnatý (1:1), no hneď na to sa vyzráža objemná masa meďnatej soli DAA. No ak sa z roztoku voda ďalej odparuje (na vodnom kúpeli), až sa zriedený roztok chloristanu Cu zmení postupne na taveninu jeho hydrátov (a táto voda sa taktiež postupne uvoľňuje), aj Cu (DAA)2 sa začína postupne rozpúšťať, až sa celá zmes zmení na tmavomodrú, priezračnú hustú taveninu (popri tom nenastáva žiadny rozklad - zápach, či tvorba plynov), ktorá tuhne na krehkú sklovitú látku (v ktorej štruktúre badať akoby ihlicovité kryštály, to ale môže byť aj nepatrný nadbytok niektorého z prekurzorov). Tá sa pri kontakte s vodou rozpúšťa na tmavomodrý roztok, z ktorého, ako sme už spomenuli, sa o chvíľu na to opäť vyzráža objemný Cu (DAA)2. Sklovitá hmota sa po párdňovom státí na vzduchu mení na stále číru hmotu, konzistenciou pripomínajúcu epoxidovú živicu. Určité množstvo vody teda priberie, no nie dosť na to, aby sa vyzrážal Cu(DAA)2, hoci len v malom množstve. Látka sa už pri konštantnej vlhkosti vzduchu ďalej nemení, ďalšiu vodu neabsorbuje. Len zmenou teploty sa mení jej viskozita, s klesajúcou teplotou tuhne, ale takisto sa dá len niekoľkominútovým ohrevom na vodnom kúpeli zmeniť opäť na sklenú hmotu. Na prvom obrázku nižšie je "vysušený", sklený Cu(DAA)ClO4.xH2O, na druhom už navlhnutý, no stále nerozložený, extrémne priľnavý a nestekajúci zo stien misy:


Zlúčenina v takejto forme "iónovej živice" je vhodná ako energetický plastifikátor (hoci len pre uľahčenie lisovania) pre práškové trhaviny (s ktorými nereaguje samozrejme). Toto bude otestované. Odhadom z dostupných informácií by podobná zlúčenina s dusičnanovým aniónom miesto chloristanového mala byť výkonnejšia. Výhodou takýchto kov obsahujúcich zlúčenín v porovnaní so "sklami" a "živicami" len na báze aminokyseliny a energetického aniónu môže byť ich menšia kyslosť, ľahšia iniciovateľnosť a menší kritický priemer kompozitov ich obsahujúcich.
Vyššie spomínanú látku sme skúšali rozpustiť/zmyť z povrchu sklenej misy. So studeným acetónom alebo alkoholom nejaká viditeľná reakcia prebiehala pomaly, preto sme misu zohrievali takmer po bod varu alkoholu, až kým sa prilepený nános postupne uvoľňoval. Lieh už bol modrý a mútny:

Lieh bol mútny od malého množstva vločkovitej zrazeniny, pravdepodobne meďnatej soli DAA. Keď sa všetka hmota od skla oddelila, liehový roztok sme zliali a tuhú hmotu, akoby želatínovej konzistencie, sme dali sušiť na kus papiera. Po dvoch dňoch sa na naše veľké prekvapenie hmota zmenila na dokonale suché, ľahko mrvivé zlepence farby kráľovskej modrej. Aj papier pod látkou bol dokonale suchý. Na obrázkoch nižšie je látka ešte vlhká od liehu, na druhom už suchá:




