Zásadité aminotetrazolatochloristany meďnaté
Autora nižšie spomenutých zlúčenín inšpiroval americký patent US 200402200554. Konkrétne táto reakcia:
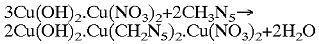
V patente sa uvádza, že 5-aminotetrazol je v molekule zásaditého dusičnanu meďnatého schopný nahradiť najviac len dve hydroxylové skupiny.
Zásaditý dusičnan meďnatý bol pokusne nahradený zásaditým chloristanom a chlorečnanom, a zdá sa, že aminotetrazol je v týchto zlúčeninách schopný nahradiť aj štyri hydroxyskupiny (a to bez rozpadu materskej zlúčeniny). Chlorečnany sú samozrejme hydrolyticky a termicky menej stabilné (pre zaujímavosť: hnedo-sivé produkty hydrolýzy vriacou vodou boli explozívnejšie ako pôvodné chlorečnany), preto tu budú popisované iba chloristany.
Zlúčenina Cu(ClO4)2.Cu(CH2N5)2.2Cu(OH)2 má vzhľad svetlomodrej zrazeniny:

Zlúčenina pravdepodobného zloženia Cu(ClO4)2.2Cu(CH2N5)2.Cu(OH)2 je tmavozeleno-tyrkysová:


Pri reakciách sa niekedy prechodne tvoril aj aminotetrazolát meďnatý (svetlozelená zrazenina), ktorý ale hneď vstupoval do reakcie.
Vzorky zlúčenín aj po niekoľko dňovom sušení vážili stále o niečo viac než by teoreticky mali, pravdepodobne obsahovali hydrátovo viazanú vodu. Ich hmotnosť sa ustálila na teoretickej asi po 2 týždňoch sušenia pri izbovej teplote. Spomenuté chloristany majú veľmi vysokú teplotu zápalu a ľahko detonujú (hlavne pri pomalom zohrievaní alebo v uzavretom priestore) aj v nepatrných množstvách, pričom väčšinou nemali tendenciu deflagrovať. Zlúčeniny sú stabilné, na mechanické podnety nie príliš citlivé. Tieto chloristany samozrejme nemajú brizanciu ich "vzdialeného príbuzného" aminotetrazolatochloristanu distrieborného, aj kvôli tomu, že energetická zložka molekuly je "zriedená" hydroxidom meďnatým.
V molekule prvej zlúčeniny bolo skúšané nahradiť hydroxid meďnatý glycerolátom (teoreticky by na 3 molekuly zásaditého aminotetrazolatochloristanu mali pripadnúť max. 4 molekuly glycerolu), podobne ako hydroxid v zásaditých chlorečnanoch a chloristanoch olovnatých (patent US1206456):

Zlúčenina je na rozdiel od predchádzajúcich vo vode čiastočne rozpustná a bolo problémom ju izolovať - tvorila gélovitú zrazeninu. Suchý výsledný produkt mal tmavomodrú farbu a bol značne explozívnejší ako pôvodná zlúčenina:

Chloristan meďnatý aj priamo reaguje s 5-aminotetrazolom a vzniká chloristan hexakis(5-aminotetrazol)meďnatý, ktorý voľne na vzduchu po zapálení deflagruje podobne ako chloristan bis(nitroaminoguanidín) meďnatý a je pomerne citlivý na mechanické podnety (v trecej miske bol náchylný explodovať už pri miernom roztieraní). Viac informácií o tejto zlúčenine a aj jej nikelnatej alternatíve sa dá nájsť v novom patente EP 2450329A2. Podobné vlastnosti má aj komplex chloristanu meďnatého s 5,5´-diamino-3,3’-metylén-1H-1,2,4-triazolom.
Pre istotu bola testovaná stabilita aminotetrazolatochloristanov a chlorečnanov v prírodnom prostredí. Nechránené vzorky boli ponechané v jarnom a letnom období napospas počasiu niekoľko mesiacov. Vzorky po skončení experimentu nejavili absolútne žiadne známky zmeny. Zlúčenina Cu(ClO4)2.2Cu(CH2N5)2.Cu(OH)2 (skrátene teda Cu(CH2N5)2.Cu(OH)ClO4) bola taktiež skúšaná ako primárna náplň rozbušky. Rozbuška obsahovala 0,5 g ručne lisovaného pentritu, 0,07 g zlúčeniny (množstvo bolo zvolené náhodne) a 0,5 g pomaly horiacej zápalnej zlože CuO/Zn-55/45 (kvôli obtiažnej zápalnosti zlúčeniny a mimo toho táto zmes po spálení vytvára v rozbuške pevnú "zátku" - nahrádza rozbuškovú poistku). Rozbuška po iniciácii detonovala kompletne. Pri 50 mg traskaviny už nastávali zlyhávky (taktiež náhodne zvolené množstvo a bez tesnenia), pretože zlúčenina už tvorila v rozbuške s veľkým priemerom veľmi tenkú vrstvu. Bis(5-aminotetrazolato)hydroxychloristan dimeďnatý je zatiaľ neznámou (prvýkrát sa spomína na tejto stránke), ale v prírodnom prostredí značne stabilnou (no kvôli hydroxyskupine je citlivý na kyslé výpary - po zhruba roku skladovania v improvizovanom laboratóriu - starej vlhkej chate pri rieke, s občasnými výparmi kyseliny octovej, HNO3 a HCl, začal meniť farbu na modrú a pri kontakte s plameňom má tendenciu len deflagrovať), dostatočne silnou (je porovnateľná s diazoaminotetrazolátom meďnatým) a málo citlivou traskavinou.
Zásaditý chloristan meďnatý (nie len meďnatý a nie len chloristam, ale aj samozrejme chlorečnan alebo dusičnan) poskytuje široké možnosti na experimentovanie nahrádzaním hydroxyskupín energetickým aniónom (alebo aniónmi) so zápornou kyslíkovou bilanciou. Neskôr na tejto stránke budú pavdepodobne spomenuté aj iné zaujímavé zmesné soli.
(pokračovanie)


